Función Gonadal Patologica
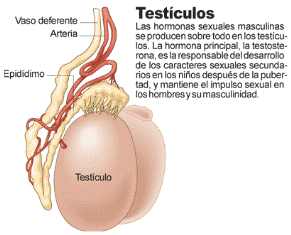
El testículo
Desde la pubertad el testículo comienza la producción de espermatozoides y de andrógenos. Los andrógenos son los responsables del tono de la voz masculina, de la presencia del vello en diferentes partes del cuerpo, de la distribución de la grasa, etc.
La producción de andrógenos y espermatozoides no es constante, y muestra oscilaciones de un día a otro.
Los espermatozoides son unas células microscópicas constituidas por una pequeña cabeza que contiene el material genético y una larga cola que les permite desplazarse.
Los espermatozoides producidos en el testículo pasan a un túbulo muy enrollado (el epidídimo) . En la cola del epidídimo se almacena el 70% de los espermatozoides. Durante el coito los espermatozoides son liberados hacia los conductos deferentes y la uretra. En el trayecto se mezclan con diferentes secreciones originadas en varias glándulas accesorias, principalmente en las vesículas seminales y la próstata.
Los espermatozoides presentes en el eyaculado (mezcla de espermatozoides y líquido seminal) no son capaces de fertilizar los óvulos a menos que presenten una serie de transformaciones conocidas en conjunto como CAPACITACION ESPERMATICA. Esta capacitación espermática se realiza normalmente en el tracto reproductor femenino; también puede realizarse en el laboratorio a través de diferentes técnicas.
Se acepta que el eyaculado es normal cuando tenga un volumen igual o mayor a 2 mL y contenga cuando menos 20 millones de espermatozoides por cada mL, de los cuales más de la mitad se muevan hacia adelante. También debe presentar más de un
30% de formas normales.
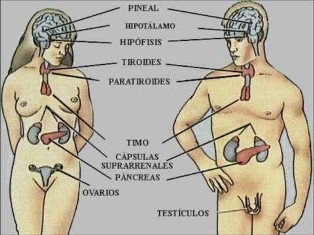
Las gónadas (testículos y ovarios )son glándulas mixtas que en su secreción externa producen gametos y en su secreción interna producen hormonas que ejercen su acción en los órganos que intervienen en la función reproductora.
Cada gónada produce las hormonas propias de su sexo, pero también una pequeña cantidad de las del sexo contrario. El control se ejerce desde la hipófisis.
EN RELACIÓN CON LAS HORMONAS.
-
En los testículos se producen las hormonas masculinas, llamadas genéricamente andrógenos. La más importante de estas es la testosterona, que estimula la producción de espermatozoides y la diferenciación sexual masculina.
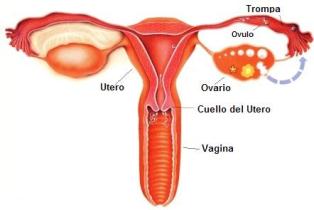
El ovario.
Desde la menarca (la primera menstruación) hasta la menopausia (la última menstruación), con excepción del periodo de embarazo, el ovario produce un óvulo en cada ciclo de la mujer. Se entiende por ciclo el lapso entre el primer día del sangrado menstrual hasta el sangrado siguiente ; un ciclo en la mujer dura en promedio 28 días. El primer día del ciclo es el primer día de sangrado menstrual.
En el ovario hay miles de pequeños quistes microscópicos conocidos como folículos; en cada folículo hay un ovocito (óvulo). Cuando empieza cada ciclo en la mujer comienzan a desarrollarse (crecer) varios folículos y a madurar sus ovocitos; los folículos y los ovocitos son estimulados por las hormonas de la glándula hipófisis. Normalmente, la mayor parte de los folículos que empezaron a crecer interrumpen su crecimiento, y un solo folículo con su óvulo (en el interior) prosigue su desarrollo. Cuando el folículo es maduro (alrededor de 20 mm de diámetro) se rompe y parte de su contenido (incluyendo el óvulo) es liberado y capturado por una estructura tubular conocida como trompa de Falopio o salpinge. Este fenómeno, la ovulación, acontece 14 días antes del siguiente período menstrual. En una mujer con ciclos de 28 días se dará en el día 14 del ciclo ; en una mujer con ciclos de 30 días en el día 16 del ciclo; y así sucesivamente.
EN RELACIÓN CON LAS HORMONAS.
- En los ovarios se segregam estrógenos y progesterona.
- Los estrógenos son los responsables del ciclo menstrual e intervienen en la regulación de los caracteres sexuales femeninos.
- La Progesterona, u «hormona del embarazo», prepara el útero para recibir el óvulo fecundado. Provova el crecimiento de las mamas durante los últimos meses del embarazo.
SÍNDROME DE OVARIOS POLIQUÍSTICOS
El síndrome de ovarios poliquísticos (SOPQ) afecta aproximadamente a un 4% de mujeres en edad reproductiva y se caracteriza por anovulación crónica e hiperandrogenismo. Es la causa más común de infertilidad en mujeres.
Se caracteriza clínicamente por acné, alopecia, hirsutismo, irregularidades menstruales e infertilidad.
Los hallazgos de laboratorio más frecuentes son: aumento de la hormona luteinizante (LH), aumento de la relación LH/FSH (hormona folículoestimulante), aumento de andrógenos (tanto ováricos como adrenales) y de estrógenos circulantes. Otros hallazgos de laboratorio habituales son una prueba tolerancia oral a la glucosa anormal y alteraciones en el perfil lipídico.
Todo esto junto con las imágenes ecocardiográficas características definen al síndrome.
La terapéutica permite dos grandes enfoques que pueden superponerse: la corrección de las manifestaciones de hiperandrogenismo y el tratamiento de las alteraciones del eje reproductivo (anovulación, esterilidad).
Los antiandrógenos están fundamentalmente indicados para tratar los síntomas virilizantes.
Las alternativas para inducir la ovulación son numerosas: al citrato de clomifeno y a la antigua resección en cuña se agregan las gonadotrofinas humanas, pulsos de GnRH (hormona liberadora de gonadotrofinas), medidas o fármacos para modificar los niveles de insulina, y finalmente técnicas quirúrgicas endoscópicas para reducir la masa ovárica.
El síndrome de poliquistosis ovárica es probablemente la endocrinopatía más predominante en las mujeres y la causa más común de infertilidad de origen anovulatorio. La población comprometida pertenece al grupo etáreo en edad de procrear. La patogénesis es desconocida y sus características clínicas y bioquímicas son heterogéneas.
Se sabe que está asociado a alteraciones metabólicas características y tiene implicancias a largo plazo sobre la salud.
El objetivo del presente trabajo es realizar una revisión actualizada de los datos publicados en los últimos años sobre este síndrome, haciendo hincapié fundamentalmente en lo que respecta a la conducta terapéutica.
DEFINICIÓN
El síndrome de ovario poliquístico es la asociación de hiperandrogenismo con anovulación crónica en mujeres sin enfermedad de las glándulas adrenales o pituitaria subyacente, con ovarios que exhiben típicas características ultrasonográficas como la presencia de más de 8 folículos menores de 10 mm de diámetro, dispuestos en forma periférica y un estoma hiperecogénico.
ETIOLOGIA
Es desconocida, se cree que sería multifactorial, como ser el incremento de los andrógenos ováricos, o ser secundaria a una disfunción hipotálamo-hipofisaria, hiperandrogenismo adrenal, e incluso a hiperinsulinismo, entre otras.
PREVALENCIA
Alrededor del mundo al menos el 20% de las mujeres en edad reproductiva tienen ovarios poliquísticos, una condición en la cual los ovarios se agrandan y desarrollan múltiples y pequeños quistes. Cerca de las tres cuartas partes de estas mujeres tienen SOPQ (síndrome de ovarios poliquísticos), el que se caracteriza por uno o más síntomas que incluyen anomalías menstruales, hirsutismo, obesidad e infertilidad. (4) El síndrome clínico de hiperandrogenismo con oligomenorrea o amenorrea se halla en el 1% al 4% de estas mujeres.
Corresponde aproximadamente a un 75% de los casos de infertilidad anovulatoria
CLÍNICA
Las mujeres con SOPQ pueden exhibir una amplia gama de síntomas clínicos. La típica presentación descripta por Stein y Leventhal consiste en una tríada clínica de amenorrea, hirsutismo y obesidad, sumada a la presencia de ovarios poliquísticos bilaterales.
El hiperandrogenismo se manifiesta como hirsutismo, acné o alopecia con patrón masculino. El hirsutismo se observa aproximadamente en el 80% de los casos, pudiendo asociarse con acné. Las zonas mas afectadas son el mentón, el labio superior, la zona periareolar y la línea media corporal anterior. (1, 3, 6) También se ha visto en algunos casos, aumento de la masa muscular y voz cada vez mas grave.
La amenorrea es interrumpida en algunas ocasiones por metrorragias. Como consecuencia de la anovulación crónica, las pacientes presentan esterilidad, que puede revertirse con tratamiento específico.
La obesidad se observa en el 50% de los casos, existiendo una estrecha relación entre esta, la resistencia a la insulina y el hiperinsulinismo.
La acantosis nigricans, caracterizada por hiperpigmentación e hiperqueratosis de la piel, afecta generalmente a la vulva, la raíz de los muslos, la nuca y las axilas.
Es sabido que esta sintomatología, no exclusiva del SOPQ, se asocia también a otras disfunciones endócrinas de etiología diversa como el síndrome de Cushing, la hiperplasia suprarrenal congénita, tumores ováricos y suprarrenales virilizantes, hiperprolactinemia, hipertiroidismo e hipotiroidismo. (5) Descartadas estas patologías, pensamos en este síndrome ante una mujer con irregularidades menstruales que probablemente desarrolle hirsutismo leve a severo junto con un incremento en los niveles de testosterona y aumento de peso (hay mujeres que no lo presentan).
Cronológicamente es frecuente que los síntomas comiencen alrededor de la pubertad, antes de la sincronización final de las interacciones hipotálamo-hipofiso-ováricas cíclicas
Por otra parte, el SOPQ está asociado con un mayor riesgo de infarto del miocardio o accidente cerebro vascular debido a factores como la hipertensión, obesidad, hiperandrogenismo e hipertrigliceridemia.
LABORATORIO
La única anomalía constante detectada en el laboratorio de pacientes con SOPQ es el hiperandrogenismo y, en concordancia, es mas apropiado efectuar un diagnóstico de hiperandrogenismo para este trastorno y no utilizar una designación de Síndrome de Stein-Leventhal.
Se observa una elevación de los niveles de progesterona libre, de androstenediona, LH (hormona luteinizante), aumento de la relación LH/FSH (hormona folículoestimulante) (en un 70% de los casos), estradiol libre, estrona e insulina en ayunas; así como una reducción de los niveles de SHBG (globulina transportadora de hormonas esteroides). Los niveles de FSH se encuentran normales o disminuidos.
La secreción adrenal se cortisol y andrógenos está incrementada en mujeres con SOPQ. Este aumento puede ser explicado por una desregulación de la 11â hidroxiesteroide deshidrogenasa, que causa una oxidación aumentada de cortisol a cortisona, la cual no puede ser explicada solamente por la obesidad.
También en el ovario hay un incremento en la producción de andrógenos, particularmente testosterona, debido a que la actividad de la 17á hidroxilasa y (en menor proporción) 17, 20 liasa están incrementadas; el efecto neto es un incremento en la producción de testosterona.
Debido a la alta prevalencia de tolerancia alterada a la glucosa y diabetes tipo II en estas pacientes, es aconsejable realizar tests rutinarios de tolerancia oral a la glucosa. Es necesario también obtener un perfil lipídico y evaluar la presión sanguínea, debido al riesgo a largo plazo de enfermedad cardiovascular.
TRATAMIENTO
La ausencia de un mecanismo causal claro en el síndrome ha llevado al desarrollo de múltiples tratamientos orientados a corregir los síntomas teniendo en cuenta las necesidades de la paciente y su situación clínica.
Las pacientes con SOPQ buscan tratamiento por tres razones principales: hiperandrogenismo, infertilidad e irregularidades menstruales.
En mujeres obesas la pérdida del 5% o más del peso corporal total es capaz de revertir severamente los síntomas. (19) Esto sería probablemente resultado de la disminución de las concentraciones de insulina y de la resistencia a ésta, con la consiguiente reducción de la producción de andrógenos ováricos y de la circulación de testosterona libre
Hiperandrogenismo:
– Hirsutismo:
Si es leve o moderado y localizado, puede ser tratado simplemente con medidas cosméticas. En casos más severos se puede ofrecer terapia medicamentosa:
El antiandrógeno mas ampliamente utilizado es el acetato de ciproterona (progesterona sintética con efecto tanto antigonadotropo como antiandrogénico). La combinación de este con etinilestradiol, logra la supresión del hiperandrogenismo con la mejoría de síntomas clínicos y la normalización de las alteraciones hormonales que caracterizan al SOPQ.
Otra droga utilizada es la Espironolactona (antagonista mineralocorticoide y antagonista de receptores de andrógenos) (3). El uso de esta se puede asociar con sangrado vaginal ocasional, por lo tanto es generalmente administrada con un contraceptivo oral.
Mas recientemente ha sido reportado el éxito del uso de antiandrógenos puros, tales como la flutamida, como así también de los agonistas de GnRH (hormona liberadora de gonadotrofinas).
Cualquiera de los esquemas empleados requiere un tiempo prolongado para que se logre la mejoría del hirsutismo, que supera en promedio los 6 meses.
– Alopecia:
Los antiandrógenos (flutamida, finasteride) son el tratamiento de elección para la alopecia andrógeno dependiente.
– Acné:
Puede ser tratado en primera instancia con una amplia gama de antibióticos, pero si estos no brindan resultados satisfactorios otras opciones incluyen los derivados del ácido retinoico y los antiandrógenos. (2)
Infertilidad:
Cuando las mujeres con síndrome de ovarios poliquísticos desean concebir, el objetivo primario es la inducción de la ovulación.
Tratamiento médico:
El tratamiento de primera elección para la inducción de la ovulación en un caso de SOPQ es el citrato de clomifeno. Esta droga brinda resultados positivos en aproximadamente un 75% de las pacientes. La resistencia a la droga en el 25% restante podría deberse a la hiperinsulinemia que acompaña a este síndrome (sobre todo en mujeres obesas).Recientemente se ha demostrado que la respuesta en este grupo de pacientes podría ser incrementada mediante la disminución de la secreción insulínica con metformina, junto con un programa de reducción de peso y ejercicios. El uso de Metformina ha sido empleado con éxito por diversos grupos sola o asociada al clomifeno.
La estimulación gonadotrófica es el siguiente paso en el tratamiento de las mujeres que son resistentes al clomifeno. Sin embargo, los resultados de la estimulación gonadotrófica en el SOPQ son poco exitosos (bajo índice de embarazos, alto índice de embarazos múltiples (25), y síndrome de hiperestimulación ovárica). En consecuencia, ciertos investigadores han logrado mejores resultados con el uso inicial de bajas dosis de gonadotrofinas, seguida de pequeños incrementos, apuntando a administrar solamente la dosis umbral de FSH que facilite la maduración de un folículo único.
Otra alternativa para lograr la ovulación monofolicular es la administración pulsátil de GnRH, con resultados poco satisfactorios. En ausencia de evidencia que sugiera un beneficio de la GnRH esta no debería ser recomendada como tratamiento estándar en este grupo de pacientes.
Tratamiento quirúrgico:
Tradicionalmente consta en la resección en cuña de los ovarios (realizada desde 1906). Restablece las menstruaciones, lográndose tasas de embarazo aceptables. Su mecanismo de acción no esta claro y acarrea el riesgo de generar adherencias que comprometen la fertilidad futura por agregado de un factor mecánico de infertilidad.
La diatermia ovárica por laparoscopia o drilling por láser fue introducida por Gjonnaess basada en el principio de poder lograr los mismos efectos de la resección en cuña evitando la lesión mecánica.
Sin embargo, estudios recientes han comparado el tratamiento médico con el manejo quirúrgico, no demostrando diferencias significativas en los resultados de ambos grupos.
Irregularidades menstruales:
Los ciclos monofásicos pueden ser tratados con gestágenos naturales como la progesterona micronizada, desde el día 15 al 25 de un ciclo artificial preestablecido, o con medroxiprogesterona, de la misma forma que el anterior. El objetivo con ambos esquemas es reducir los efectos indeseables de la estimulación estrogénica sostenida sobre el endometrio.
Los anticonceptivos orales pueden constituir otra forma de tratamiento, y permitir disminuir los niveles de LH y la producción de andrógenos ováricos, y aumentar la SHBG. Es aconsejable la utilización de anticonceptivos en dosis bajas de estrógenos y gestágenos sin efecto androgénico. Dentro de estos es útil la combinación de etinilestradiol y gestodeno, o de etinilestradiol y ciproterona.
CONCLUSIÓN
- El arsenal terapéutico farmacológico con el que se cuenta hasta ahora ha dado buenos resultados en el control de síntomas, y mejora las tasas de embarazos en las mujeres que desean descendencia.
- La reducción de peso en la paciente obesa frecuentemente logra la corrección de las anomalías de las gonadotrofinas y los esteroides sexuales, lo que conduce algunas veces a la reanudación espontánea de la ovulación, y otras veces a una reducción en las dosis de los agentes inductores de la ovulación.
- También se ha visto que mejora la resistencia a la insulina y el perfil lipídico, con la consiguiente disminución de los riesgos a que estas situaciones conllevan.
- La resección cuneiforme de ovarios constituyó por décadas el tratamiento básico del síndrome y con excelentes resultados en las manos de quienes lo describieron. Ante el éxito de las terapéuticas no quirúrgicas ha sido prácticamente abandonada en la actualidad reservándosela para circunstancias muy particulares.
- La cirugía endoscópica con la utilización del láser o el cauterio abren interesantes posibilidades de reducir masa ovárica con mínimas adherencias y buenos resultados.