Patología Tiroidea
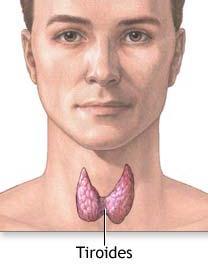
Es una glándula (endocrina) situada en la parte anterior baja del cuello. Dos terceras partes de sus células (células foliculares) fabrican hormona tiroidea o tiroxina. Las células C fabrican otra hormona llamada calcitonina, que ayuda a controlar el nivel de calcio en la sangre.
El tiroides tiene forma de mariposa, tiene dos partes o lóbulos unidos por el istmo que se apoya en la tráquea justo por debajo de la laringe. Los lóbulos rodean la tráquea lateralmente situándose entre el esófago y las arterias carótidas. La glándula tiroides pesa aproximadamente 20 gramos y cuando es de tamaño normal no es palpable a través de la piel.
Esta glándula utiliza yodo para fabricar la tiroxina. Esta hormona tiene un efecto muy amplio sobre el metabolismo celular, el consumo de oxígeno y energía, la producción de calor, el crecimiento y el desarrollo.
La función de la glándula tiroides está regulada por la hipófisis, que es otra glándula situada en la base del cerebro que segrega, entre otras hormonas, la TSH (Thyroid stimulating hormone).
¿Qué es el bocio?
Bocio es todo crecimiento o aumento de tamaño de la glándula tiroides. Puede ser difuso o nodular. El aumento de la glándula se puede dar en casos de hipertiroidismo (exceso de producción de hormona tiroidea) como la enfermedad de Graves-Basedow y en casos de hipotiroidismo.
El bocio nodular puede ser por nódulo único o por la presencia de varios nódulos (multinodular).
¿Qué es un nódulo tiroideo?
Nódulo significa “bulto” o tumor. Estos tumores suelen ser benignos, pero un 5-10% aproximadamente son malignos. Son muy frecuentes, son palpables en un 5% de la población adulta y mas frecuentes en la mujer que en el hombre. Generalmente no afectan a la función tiroidea y son por tanto asintomáticos. Pueden ser sólidos o quísticos.
Factores de riesgo de malignidad
- Edad: el riesgo de que un nódulo sea canceroso en un niño menor de 14 años es aproximadamente de un 50%.
- Sexo: aunque los nódulos tiroideos son más frecuentes en las mujeres, cuando aparecen en el hombre, el riesgo de cáncer es mayor.
- Un nódulo de aparición reciente o que crece rápidamente puede ser canceroso. Un nódulo que aumenta bruscamente de tamaño y es doloroso suele ser por hemorragia en el interior de un adenoma (tumor benigno).
- La historia de irradiación en la zona de cabeza y cuello favorece la aparición de nódulos y cáncer de tiroides.
- La historia familiar de cáncer de tiroides.
- Son signos sospechosos de cáncer de tiroides la presencia de un nódulo duro, fijado a los órganos vecinos, la aparición de adenopatías (ganglios) o afonía.
Para hacer el diagnóstico correcto y descartar la malignidad de un nódulo tiroideo, aparte de la historia clínica y la exploración, las pruebas mas útiles son la punción citológica con aguja fina (PAF), la ecografía y la analítica.
Las indicaciones de tratamiento quirúrgico (necesidad de cirugía) en el nódulo tiroideo son principalmente:
- Sospecha de malignidad.
- Nódulo de gran tamaño. Mayor de 3-4 cm. Porque puede comprimir la traquea, producir molestias y por su efecto estético.
- En algunos casos de hipertiroidismo.
¿que es el bocio multinodular?
Bocio multinodular es el aumento de tamaño del tiroides por la aparición de varios nódulos o “bultos” en su interior. Él mas frecuente es el bocio adenomatoso. También puede ser secundario a una tiroiditis (inflamación de la glándula) o en algunos casos de hipertiroidismo como la enfermedad de Plummer. Los bocios multinodulares raramente son malignos.
El bocio endémico es debido a la falta de yodo en la dieta. Antiguamente era frecuente en ciertas partes de España como en la comarca de Las Hurdes o el Pirineo de Huesca. Hoy en día, con la adición de yodo al agua y la sal, prácticamente ha desaparecido. En estos casos el tiroides podía llegar a ser gigante y producir graves efectos obstructivos y estéticos.
En muchos casos de bocio multinodular, la función de la glándula tiroidea es normal (resto de tejido sano entre los nódulos). Si la función es normal, los nódulos no son de gran tamaño y no existe sospecha de cáncer pueden ser controlados sin necesidad de cirugía. Cuando estos bocios son de gran tamaño pueden producir síntomas por compresión de la traquea (ahogo), del esófago (Disfagia o dificultad para la deglución), de las venas del cuello (edema o hinchazón de la cara) o pueden emigrar por debajo de las clavículas y esternón al interior del tórax. Antes de llegar a estos extremos es aconsejable el tratamiento quirúrgico.
¿Qué es el hipertiroidismo?
Cuando el tiroides trabaja demasiado y por tanto produce demasiada hormona tiroidea aparece el hipertiroidismo. El exceso de tiroxina actúa sobre todas las células del organismo acelerando su metabolismo, lo que se traduce en síntomas como el exceso de calor, sudoración, taquicardia (aceleración del ritmo cardíaco), nerviosismo, temblor, pérdida de peso, diarrea, cansancio muscular, etc.
La causa más frecuente de hipertiroidismo es la enfermedad de Graves-Basedow, en la que el sistema inmunológico del organismo sobre-estimula al tiroides. Aparte del hipertiroidismo estos pacientes pueden tener exoftalmos, un proceso que afecta a los ojos y que los hace aparecer mas abiertos y “saltones”. El tratamiento de esta enfermedad suele ser médico, se administra una medicación oral antitiroidea. Si esto no es efectivo o el hipertiroidismo vuelve a aparecer (recidiva) puede tratarse con yodo radioactivo que destruye las células tiroideas o con cirugía extirpando la mayor parte de la glándula.
En algunos casos el hipertiroidismo es producido por un nódulo (nódulo tóxico) o por varios nódulos (enfermedad de Plummer), estos nódulos trabajan más de lo normal y de forma autónoma, es decir no son regulados por la hormona hipofisaria TSH. El tratamiento suele ser quirúrgico.
Tiroiditis
Las tiroiditis se clasifican en: infecciosa aguda, subaguda, autoinmune, fibrosa, inducida por fármacos y por radiación. La tiroiditis de Hashimoto, la tiroiditis posparto y la tiroiditis esporádica no dolorosa tienen una base autoinmune, con altos niveles de anticuerpos antitiroideos, desencadenada según algunas teorías, por un virus con una proteína de estructura similar a las tiroideas o, en mujeres, por la acumulación de células fetales en el tiroides materno durante el embarazo.
Antecedentes históricos.
La glándula tiroides, del griego thyreos y eidos, significa forma de escudo. Su nombre fue dado por Wharton en 1656. Aunque su descubridor fue Vesalius en 1534 es de señalar que desde 1500 se conocía la existencia del bocio. Pasarían casi 2 siglos antes de que se precisara su importancia fisiológica.
Entre 1825 y 1845, Parry, Graves y Basedow describieron el bocio tóxico difuso.
En 1884 se realizó por Rehn la primera tiroidectomía subtotal como tratamiento del hipertiroidismo, y en 1888 Ord describió el cuadro clínico ya reportado por Gull, el cual se corresponde con el hipotiroidismo primario; pero desde siglos atrás, en China se conocía el beneficio del consumo de algas marinas y esponjas, aunque para la literatura occidental es en 1891 que se emplea el extracto del tiroides para el tratamiento del hipotiroidismo.
En 1895 Baumann descubrió la presencia de yodo en el tiroides unido a la globulina, y llamó a esa sustancia yodotirina; Oswald, años después, aisló una proteína yodada a la que llamó tiroglobulina.
En 1811 se describió el carcinoma primario del tiroides; en 1896 Riedel la tiroiditis crónica que hoy lleva su nombre; en 1912 Hashimoto describió la tiroiditis crónica; en 1914 Kendall aisló la tiroxina, aunque no fue hasta 1926 que Harrington determinó que es un derivado de la tirosina con 4 átomos de yodo; años más tarde Pitt Rivers y Gross identificaron la T3.
Entre 1917 y 1975 se reportó:
El efecto bociógeno del yodo y otras sustancias (desde un siglo antes ya se asociaba el yodo con el bocio).
Hipertiroidismo por yodo.
El efecto de las tioureas y las sulfonamidas sobre la función tiroidea y se inició el empleo del metiltiouracilo, el propiltiouracilo y el metimazol, como parte del tratamiento del hipertiroidismo.
Defectos en las hormonosíntesis del tiroides.
Los anticuerpos antitiroglobulina y el LATS.
Se inició el uso del I131.
Definiciones operacionales.
Enfermedad autoinmune del tiroides: Incluye diferentes entidades (tiroiditis de Hashimoto, hipotiroidismo idiopático, enfermedad de Graves) que clínicamente pueden presentar o no bocio, así como disfunción tiroidea. Su diagnóstico se realiza con la conjunción de alguno de los siguientes elementos:
Presencia de anticuerpos contra la tiroglobulina, la tiroperoxidasa o el receptor para la TSH,
Infiltración linfocitaria del tejido tiroideo y
Cuadro histológico/citológico típico de enfermedad de Hashimoto.
Enfermedad tiroidea posparto: Disfunción tiroidea que ocurre entre los 3 y 12 meses posparto. Se excluyen los cuadros que permanecen posteriormente a los 12 meses. Puede recurrir en nuevas gestaciones.
BAF, CAF: Citología con aguja fina.
CAAF o BAAF: Citología o biopsia por aspiración con aguja fina.
Fisiología de la glándula tiroides.
La producción de las hormonas tiroideas.
La producción y almacenamiento de hormonas se lleva a cabo en los folículos, en cuyo interior se encuentra un material denominado coloide, compuesto fundamentalmente por la tiroglobulina producida por las células epiteliales que limitan cada folículo.
La materia prima necesaria para la formación de las hormonas tiroideas es el yodo, que ingresa al organismo con la dieta, en forma de yoduros y que, una vez incorporados, son oxidados por medio de la peroxidasa, y luego fijados al aminoácido tirosina de la tiroglobulina, en un proceso denominado organificación
Cuando la glándula recibe estímulo para secretar sus hormonas, capta el coloide y lo hidroliza para liberar T3 y T4 al plasma. Pero el transporte y el reservorio de estos productos en sangre depende de proteínas transportadoras, fundamentalmente «la globulina fijadora de tiroxina» (TBG) o proteína transportadora de compuestos yodados (PBI). La mayor parte (99%) de la T4 y la T3 circulan en sangre en su forma ligada (inactiva) y sólo en una proporción muy pequeña en su forma libre (activa).
La T4 se secreta aproximadamente 10 veces más rápido que la T3, pero esta última es más potente, por lo tanto en hígado, riñón y otros órganos la T4, por monodesyodación, se convierte en T3.
La inactivación de los excedentes, se verifica principalmente en el hígado -glucoconjugación- seguida de eliminación por la bilis, orina, saliva, mucosa gástrica y una parte pequeña, se elimina por la leche materna durante la lactancia.
Respuestas tisulares a las hormonas tiroideas.
En el metabolismo general, y en dosis fisiológicas, las hormonas tiroideas intervienen de la siguiente manera:
favorecen la síntesis de proteínas y glucógeno;
aumentan la absorción de carbohidratos y proteínas en el tubo digestivo;
ejercen una acción lipolítica, ya que estimulan el catabolismo del tejido graso;
favorecen un aumento del aporte de oxígeno a los tejidos, incrementando el volumen minuto cardíaco y la velocidad en reposo de la ventilación pulmonar;
favorecen el aumento de la masa de eritrocitos y, consecuentemente, la capacidad de transporte de oxígeno;
en el sistema nervioso, regulan la mielinización de las fibras y favorecen el crecimiento normal de las neuronas;
regulan el crecimiento y desarrollo, la tensión arterial, la temperatura corporal;
participan de manera preponderante durante el desarrollo fetal y en los primeros estadios de la infancia;
son imprescindibles para la maduración tardía ósea y la maduración del pulmón.
Todas estas acciones permiten afirmar que las hormonas tiroideas participan en el metabolismo regulando los procesos energéticos y optimizándolos cuando las circunstancias lo requieren, como ser en las etapas de cambio. Si bien estas hormonas actúan directamente a nivel celular, en el cerebro, las gónadas y órganos linfáticos actúan de manera indirecta. En estos tejidos, actúan facilitando el transporte de aminoácidos a través de la membrana celular lo que favorece la síntesis de proteínas.
Regulación de la función tiroidea.
El control primario de la función tiroidea está mediado por la hormona estimulante de la tiroides (TSH) secretada por la adenohipófisis en respuesta a la hormona liberadora de tirotropina (TRH), secretada por el hipotálamo.
La capacidad de respuesta de la hipófisis a la TRH está bajo un control de retroalimentación negativa (feed back) de la T4 y T3: un exceso de hormonas tiroideas circulantes disminuye la respuesta de las células tirotropas a la TRH y un déficit de esas hormonas, aumenta su respuesta.
Métodos diagnósticos en las afecciones del tiroides.
Estudios hormonales:
Si bien en otras latitudes se considera que precisar los niveles plasmáticos de TSH (con el empleo de un método ultrasensible) debe ser el primer complementario a indicar para establecer el estado de función tiroidea con vista a incrementar la utilidad de los métodos diagnósticos al alcance, para definir el estado de la función tiroidea, en estos casos se debe indicar T4 libre (en su defecto T4 total) o PBI.
Si los resultados de T4 libre son normales, no existe disfunción; si son elevados, es probable la hiperfunción tiroidea (recordar que en el embarazo, el uso de estrógenos aumenta los niveles de T4 libre y total y que el uso de yoduros incrementa el PBI).
Si los resultados de T4 libre están disminuidos es probable la hipofunción. En estos casos, se debe indicar a continuación TSH plasmática que, de estar elevado, confirmaría la génesis primaria o tiroidea del hipotiroidismo. Si cuando clínicamente se sospecha este, es posible iniciar el estudio por esta determinación sin evaluar los niveles de T4 libre (en su defecto T4 total).
Si la TSH estuviera disminuida se requerirá evaluar la función hipotálamo hipofisaria.
Para seguimiento de paciente bajo tratamiento por hipertiroidismo, solo será necesario indicar o determinar los niveles plasmáticos de T4 libre (en su defecto T4 total). En caso de hipotiroidismo primario, se evalúan los niveles plasmáticos de TSH. Si existe hipotiroidismo secundario/terciario, evaluar los niveles de T4 libre (en su defecto T4 total), los que deberán estar en el límite superior del rango de referencia.
Para seguimiento de pacientes con tiroiditis, se requerirá evaluar en conjunto los niveles de TSH y T4 libre (en su defecto T4 total) indicados como mínimo 15 días después de suspender el tratamiento con levotiroxina.
Estudios inmunológicos.
Para determinar la presencia de un componente inmunológico como etiología de un bocio con o sin disfunción tiroidea, se deberán determinar los niveles plasmáticos de anticuerpos contra la tiroperoxidasa.
Los niveles de anticuerpos antitiroglobulina se indicarán ante todo paciente en el que se sospeche tiroiditis de Hashimoto y en aquellos en que se requiera determinar niveles de tiroglobulina sérica.
Los anticuerpos contra el TSH se indicarán en pacientes con bocio tóxico difuso y en los que presenten madres con esta afección.
Estudios con radioisótopos.
Estudios con radioisótopos (131I o con Tc- 99) permiten conocer la avidez del tiroides por el radioisótopo, según el cual es posible clasificar los nódulos de más de 1 cm, como nódulos fríos o hipocaptantes, calientes o hipercaptantes e isocaptantes o tibios.
No son útiles para establecer el estado de función del tiroides.
Gammagrafía tiroidea:
Se indicará la gammagrafía tiroidea en:
Paciente con bocio difuso siempre y cuando se sospeche como etiología bocio enzimático, bocio por yoduros o tiroiditis subaguda o silentes.
Paciente con nódulo del tiroides siempre y cuando se demuestre que es sólido (por ultrasonido) o si se acompaña de hiperfunción tiroidea clínica.
Paciente con tiroidectomía total por carcinomas del tiroides de origen folicular, siempre que sea posible emplear Tc-99.
En el diagnóstico de nódulos tiroideos si no tenemos al alcance ningún otro método (ultrasonido o BAF).
En el diagnóstico de malformaciones congénitas de la glándula, indicar estudio con Tc-99, aunque en ocasiones se emplea I131.
Estudios imagenológicos.
1. Ultrasonido del tiroides. Se indicará en:
Paciente con bocio difuso o sin él cuando se necesite buscar presencia de nódulos no palpables, como ocurre en familiares de pacientes con cáncer de tiroides, con feocromocitoma o con hipertensión arterial.
Pacientes con bocios nodulares o con nódulos únicos del tiroides, con el objetivo de precisar si este es sólido o quístico, su tamaño y posición o ubicación, además de determinar las características ecogénicas del resto del tiroides.
2. Rx simple de cuello y tórax. Se indicará ante la presencia de bocios con sintomatología compresiva.
3. Tomografía computarizada y la resonancia magnética de cuello y tórax. Pueden ser útiles para definir compresión, desplazamientos u otro tipo de conflicto de espacio producido por aumento de volumen del tiroides u otros órganos del cuello o del mediastino.
Biopsia con aguja fina.
Se indicará en todo paciente que se necesite precisar la etiología de un bocio nodular o difuso.
No está indicada en pacientes con bocio tóxico difuso, al menos mientras el paciente esté hipotiroideo.
Se considera que este proceder permite identificar:
Lesiones quísticas (adenomas o bocios adenomatosos con degeneración quística).
Lesiones inflamatorias (tiroiditis linfocitarias, subagudas o de Quervain, de Hashimoto).
Tumores o lesiones foliculares.
Tumores de células de Hurtle.
Carcinomas (papilar, medular e indiferenciados).
Linfomas.
Otros tumores raros.
Definición de tiroiditis.
El término «tiroiditis» indica una inflamación tiroidea y comprende un conjunto de enfermedades de diferentes orígenes y con diferentes enfoques y tratamiento.
Clasificación de las tiroiditis.
Tiroiditis infecciosa aguda o supurada
Tiroiditis subaguda granulomatosa (De Quervain)
Tiroiditis autoinmune
Tiroiditis linfocitaria crónica (Hashimoto)
Tiroiditis atrófica
Tiroiditis linfocitaria subaguda (tiroiditis post parto, tiroiditis silente indolora esporádica)
Tiroiditis focal
Enfermedades no autoinmunes con respuesta inmunitaria secundaria (tiroiditis granulomatosa subaguda, carcinoma papilar de tiroides, bocio multinodular tóxico)
Tiroiditis fibrosa (Riedel)
Tiroiditis por fármacos
Tiroiditis por radiación
TIROIDITIS INFECCIOSA AGUDA Y/O SUPURADA.
Proceso infeccioso agudo localizado en el tiroides que puede tener carácter supurativo. El tiroides suele ser poco susceptible a la infección, en relación con la riqueza vascular y de drenaje linfático, por su alto contenido en yodo (acción bactericida) y por la cápsula fibrosa que le aísla de los órganos vecinos.
Etiología:
La etiología de este proceso es bacteriana en la mayoría de los casos (70%) (estreptococo, estafilococo, neumococo, etc.), si bien también pueden intervenir hongos, micobacterias o parásitos.
La afectación puede ser por mera contigüidad, por vía sanguínea o linfática, o más frecuentemente como consecuencia de la presencia de una fístula del seno piriforme.
Ocurre frecuentemente en pacientes con patología tiroidea previa (cáncer tiroideo, tiroiditis de Hashimoto, bocio multinodular) y en sujetos ancianos o inmunosuprimidos.
En los últimos años al prolongarse la vida en pacientes con sida, tras la administración de inhibidores de proteasas, la tiroiditis infecciosa es de evolución insidiosa, ocasionadas por gérmenes no habituales entre los que destaca por su frecuencia el Pneumocystis Carinii.
Patología:
La anatomía patológica se caracteriza por la presencia de infiltrados polimorfonucleares y/o linfociticos, focos necróticos y hallazgo frecuente de zonas abscesificadas.
Clínica:
El paciente refiere dolor en región precervical con signos de tumefacción local, disfagia, disfonía, tos, fiebre y presencia ocasional de adenopatías cervicales.
La presencia de dolor «tiroideo» implica el establecimiento del correspondiente diagnostico diferencial entre diferentes patologías estrictamente tiroideas y otras afectaciones extratiroideas.
Pruebas complementarias:
El laboratorio muestra la existencia de leucocitosis, velocidad de sedimentación elevada y positividad ocasional del hemocultivo.
Se puede comprobar la presencia de «áreas frías» en la gammagrafía tiroidea en caso de tiroiditis supurativas.
La función tiroidea suele ser normal en la mayor parte de los casos.
La punción-aspiración con aguja fina (PAAF) y la correspondiente tinción de la muestra citológica puede en ocasiones confirmar el diagnostico etiológico.
La ultrasonografía (US), la tomografía axial computarizada (TAC) o la resonancia magnética (RM) pueden colaborar a veces en el diagnostico diferencial de esta entidad.
En caso de sospecha de fístula de seno piriforme se puede acudir a la administración oral de contraste baritado.
Tratamiento:
Tratamiento antibiótico y drenaje quirúrgico si la presencia de abscesos lo precisa.
Deberá extirparse la fístula del seno piriforme en caso de presencia de abscesos en la glándula tiroides para evitar una posible recidiva del proceso infeccioso.
TIROIDITIS SUBAGUDA O DE DE QUERVAIN (TIROIDITIS GRANULOMATOSA DE CÉLULAS GIGANTES).
Proceso inflamatorio autolimitado, de duración aproximada de 4-9 meses, que ocurre hasta en un 5% de casos en pacientes con enfermedades tiroideas clínicas previas.
Etiología:
Etiología probablemente vírica (parotiditis, influenza, adenovirus, cosackievirus, virus Epstein-Barr, enterovirus, etc.), surgiendo en ocasiones después de la presencia de infecciones del tracto respiratorio superior y habiéndose descrito ocasionalmente mayor incidencia en verano, en relación con presencia de cuadros de infección por enterovirus.
Existe divergencia respecto a la concomitancia de positividad específica de anticuerpos antivíricos y el desarrollo de tiroiditis subaguda.
Se ha descrito también la participación de ricketsiosis como causa de esta tiroiditis granulomatosa.
A veces se ha objetivado la asociación al antígeno de histocompatibilidad HLA-Bw35, en diferentes grupos étnicos, o a HLA-DRw8 en población japonesa.
Es más frecuente su presencia en mujeres frente a hombres (5/1), predomina entre la tercera y quinta década de la vida y puede a veces presentar recidivas (2% casos).
Patología:
Existe destrucción folicular, acompañada de infiltración de células mononucleares y formación ulterior de lesiones granulomatosas con presencia de células «gigantes» que muestran sustancia coloide fagocitada en su interior.
Clínica
Se debe destacar la existencia de una fase prodrómica caracterizada por malestar general, mialgias y febrícula que se sigue de la aparición de dolor en la parte anterior de cuello, con irradiación ocasional a región mandibular y pabellón auricular y sensación de disfagia. Existe un discreto aumento del tamaño tiroideo, de consistencia firme y sensible a la palpación.
Con respecto a la repercusión de la tiroiditis subaguda de De Quervain sobre la función tiroidea, hemos de reconocer de manera simplificada la posible existencia de tres fases evolutivas, aunque en ocasiones no sea tan clara esta esquematización:
1. Fase de tirotoxicosis:
Se manifiesta en un 50% de casos y se debe a la destrucción tiroidea con liberación consiguiente de las hormonas tiroideas preformadas y de tiroglobulina. Junto al correspondiente aumento de niveles plasmáticos de T3 y T4, se comprueba descenso de los niveles de hormona estimuladora del tiroides (TSH) y de la captación tiroidea de I131 que se acompaña de una imagen gammagráfica apenas detectable.
En la ultrasonografía con eco-doppler se detecta una hipoecogenicidad difusa y un flujo vascular normal o disminuido, a diferencia de la enfermedad de Graves en la que la elevación plasmática de hormonas tiroideas se asocia con manifiesta hipervascularidad.
2. Fase de hipotiroidismo:
A las pocas semanas de evolución suele corregirse la tirotoxicosis y asistimos a la aparición de una disminución de la función tiroidea (descenso de T4 y T3, y aumento de TSH), como consecuencia de la destrucción folicular previamente referida.
Este hipotiroidismo suele ser generalmente transitorio y solo se transforma en definitivo en un 5% de casos.
3. Fase de recuperación:
A los 6-9 meses de instauración de la tiroiditis, la función tiroidea va progresivamente restaurándose, comprobándose un aumento paulatino de la captación tiroidea de I131 y una normalización de los diversos parámetros hormonales.
Pruebas complementarias:
Analíticamente se puede comprobar un aumento de la velocidad de sedimentación globular y de los valores de proteína C reactiva
Puede existir en ocasiones aisladas una positividad de anticuerpos antitiroides: antiperoxidasas (anti-TPO) y antitiroglobulina (anti-Tg)
* Si bien el cuadro clínico de la tiroiditis subaguda es bastante sugestivo para llevar a un diagnostico definitivo, en ocasiones debe acudirse para su confirmación a la práctica de PAAF.
Tratamiento:
El tratamiento, fundamentalmente es sintomático, se centra en la administración de acido acetilsalicílico o fármacos antiinflamatorios no esteroideos (AINE).
Si el dolor es intenso los corticoides pueden ser útiles (40 mg de prednisona diaria que se retiran progresivamente en 4 a 6 semanas). El tratamiento actúa sobre la clínica y no sobre la causa subyacente por lo que es importante no interrumpirlo precozmente pues los síntomas pueden exacerbarse.
En algunas ocasiones pueden ser necesarios betabloqueantes (Propranolol 10 mg/8 horas) para el tratamiento de la fase de tirotoxicosis, o tiroxina ante la presencia de hipotiroidismo.
Rara vez es necesario administrar hormona tiroidea ya que la fase hipotiroidea suele ser leve y transitoria.
En ocasiones, cuando existe una pobre respuesta puede acudirse al empleo de glucocorticoides, si bien es preciso recordar la tendencia a recidivar la enfermedad cuando se suspenden los mismos.
TIROIDITIS AUTOINMUNES.
Dentro de las tiroiditis que reconocen un origen autoinmune se han descrito diversas variedades, tales como tiroiditis linfocitaria crónica (Hashimoto), tiroiditis atrófica, tiroiditis linfocitaria subaguda (posparto o silente esporádica), tiroiditis focal.
1. TIROIDITIS CRÓNICA AUTOINMUNE (HASHIMOTO).
Epidemiología
La prevalencia de tiroiditis crónica autoinmune varía según los criterios diagnósticos empleados (presencia de anticuerpos antitiroides, elevación de TSH o infiltración linfocítica tiroidea).
De la recopilación de diversos estudios parecen deducirse los siguientes dates fundamentales: existencia de lesiones de tiroiditis en aproximadamente un 30% de necropsias de mujeres adultas, presencia de anticuerpos antitiroides en un 10%-15% de mujeres y en un 3% de hombres y hallazgo de hipotiroidismo subclínico y clínico en un 5%-10% y en 1% de mujeres y hombres, respectivamente.
La conversión a hipotiroidismo manifiesto a partir de la comprobación de una positividad de anticuerpos antitiroideos suele ser lenta (25% de casos aproximadamente a los 20 años de seguimiento).
La prevalencia de anticuerpos antitiroides se incrementa con la edad y muestra variaciones étnicas.
Factores genéticos:
La autoinmunidad tiroidea presenta un componente familiar importante, pues se ha objetivizado en familiares de primer grado de pacientes con tiroiditis crónica autoinmune una positividad para anticuerpos antitiroides, así como la posible presencia de enfermedad de Hashimoto o enfermedad de Graves.
Se ha descrito asociación de la tiroiditis autoinmune (Hashimoto, tiroiditis posparto) a determinados antígenos de histocompatibilidad (HLA-DR3, HLA-DR4, HLA-DR5) en personas caucásicas, asociación que puede variar entre diferentes etnias o grupos raciales.
En tiroiditis de Hashimoto de presentación familiar se ha observado asimismo la asociación al gen de la proteína-4 del linfocito T citotóxico (CTL-4).
Patogenia:
Proceso autoinmune que se pone en marcha por activación de los linfocitos T helper (CD4), motivada por una pérdida de la inmunotolerancia central (tímica) o periférica y/o por disminución de la actividad de los linfocitos T supresores, todo ello en el contexto de un determinado fondo genético que ya hemos comentado y ante la posible influencia de factores externos (bacterias, virus, yodo, tabaco, factores hormonales, estrés)».
La activación de linfocitos T helper se ha propuesto es producida por:
liberación de antígenos tiroideos ocultos o neoformación de antígenos, existencia de «identidad» molecular antigénica entre virus y células foliculares tiroideas
acumulación de células fetales en tiroides materno durante el embarazo (tiroiditis posparto)
expresividad en células foliculares tiroideas de antígenos HLA clase II, convirtiéndolas en células presentadoras de antígenos. Este ultimo mecanismo más que iniciador del proceso autoinmune parece ser perpetuador de la autoinmunidad.
En este sentido, las células T previamente activadas, a través de la liberación de citocinas (factores interferón-γ y factor de necrosis tumoral alfa [TNF-α]) inducirán la expresión de anfígenos HLA clase II en las células foliculares tiroideas, así como la liberación de moléculas de adhesión y expresión de Fas y Fas-ligando (apoptosis).
La autorreactividad de los linfocitos T (CD4), arriba reseñada, va a condicionar posteriormente un estimulo de los linfocitos B y de los linfocitos T citotóxicos (CD8). Las células B producen preferentemente anticuerpos anti-TPO y anti-Tg, así como ocasionalmente anticuerpos bloqueadores (Ab-TSH) o estimuladores (Ac-TSM) del receptor tiroideo de TSH, junto con anticuerpos frente al anfígeno soluble del coloide, hormonas tiroideas o transportador tiroideo de yodo ó sodium iodide symporter (NIS).
La producción de anticuerpos anti-TPO interfiere la organificación tiroidea del ioduro, al tiempo que los Ab-TSH pueden contribuir al posible desarrollo de hipotiroidismo. El efecto lesional en la tiroiditis de Hashimoto parece estar fundamentalmente mediado por acción directa de células T citotóxicas (CD8) o indirecta a través de citotoxicidad activada por el complemento, mediada por anticuerpos con participación de células natural killer (NK) o por la intervención de citocinas proapoptóticas.
Clínica
La tiroiditis de Hashimoto es 8-9 veces más frecuente en mujeres y la mayor incidencia se halla entre los 30-50 años
Hay bocio de carácter «abollonado» y consistencia firme, no doloroso, con engrosamiento ocasional del lóbulo piramidal.
A veces puede presentarse de manera excepcional y transitoriamente un cuadro de hipertiroidismo (hashitoxicosis) por liberación de anticuerpos estimuladores del receptor de TSH.
En la mayoría de los casos se desarrolla sucesivamente de forma progresiva un hipotiroidismo subclínico y un hipotiroidismo clínico, pudiendo en un 10% de casos culminar esta situación en un autentico mixedema (atrofia tiroidea).
La tiroiditis de Hashimoto se puede asociar a otras endocrinopatías autoinmunes (diabetes tipo I, enfermedad de Addison), formando parte en ocasiones de los denominados síndromes de insuficiencia glandular endocrina múltiple tipo 1 o tipo 2, o a otras patologías no endocrinológicas también de origen autoinmune (cirrosis biliar primaria, lupus eritematoso, artritis reumatoide, síndrome de Sjögren).
Pese a su rareza, el riesgo de padecer un linfoma es 70 veces superior en las personas portadoras de tiroiditis linfocitaria crónica en comparación con la población general, si bien en esta circunstancia su pronóstico suele ser más favorable. Se trata fundamentalmente de linfomas tipo B, confinados al tiroides, que ocurren con preferencia en mujeres de 50-80 años.
Función tiroidea:
En la tiroiditis linfocitaria crónica, la velocidad de sedimentación es normal y los valores hormonales tiroideos (T3, T4) son normales o bajos (hipotiroidismo) según el curso evolutivo.
La TSH aumenta de forma progresiva en casos de hipotiroidismo subclínico (T4 y T3 normales) e hipotiroidismo manifiesto (T4 y T3 bajas).
Se encuentran anticuerpos antitiroglobulina en 25%-50% de casos y anticuerpos anti-TPO en un 90%, objetivamente la presencia de estos anticuerpos se relaciona expresamente con el daño celular, la infiltración linfocítica y la disfunción tiroidea.
Ecografía:
En el estudio ultrasonográfico el tiroides muestra un aspecto hipoecogénico, al tiempo que la exploración gammagráfica nos puede ofrecer una imagen «moteada». Se detectan a veces alteraciones en la organificación tiroidea de ioduro (anticuerpos anti-TPO) y puede objetivarse liberación plasmática de tiroglobulina u otras iodoproteínas anómalas (tiroalbúmina, iodoalbúmina).
PAAF:
Si bien no necesaria, es indudablemente útil para la confirmación diagnostica del proceso
Tratamiento:
Una vez el hipotiroidismo está establecido debe tratarse con hormona tiroidea a dosis sustitutiva: 50 microgramos diarios inicialmente (25 si edad avanzada, enfermedades cardiovasculares o consuntivas o niveles previos muy bajos de T4 libre) aumentando 25 mcrgr/ día cada 15 a 30 días según los mismos criterios, hasta 75-100 microgramos/día, ajustándose posteriormente según controles que deben dilatarse al menos 2-3 meses desde el inicio del tratamiento ya que las respuestas son lentas.
Los pacientes con hipotiroidismo subclínico con niveles altos de Ac anti-TPO debe ser tratados también por su frecuente evolución a hipotiroidismo clínico y mayor riesgo arteriosclerótico por elevación lipídica. Se indicara la administración de tiroxina ante la presencia de síntomas atribuibles al hipotiroidismo, niveles de TSH superiores a 10 mU/ml, positividad elevada de anticuerpos antitiroides, sexo masculino y edad superior a 45 años.
Si el bocio es grande debe administrase hormona tiroidea en dosis suficiente para frenar la TSH, lo que puede hacer disminuir en 6 meses hasta un 30% el tamaño de la glándula.
Si se observa un nódulo tiroideo debe ser estudiado mediante PAAF a fin de descartar carcinoma tiroideo o linfoma (raro, pero con un riesgo relativo de 67 en este tipo de tiroiditis)
A veces se ha empleado también la tiroxina en pacientes eutiroideos para conseguir un descenso del volumen del bocio, pero su eficacia es dudosa en cuanto al descenso de la tasa de anticuerpos.
2. TIROIDITIS POSPARTO (Tiroiditis linfocitaria subaguda).
Se trata de una tiroiditis linfocitaria de evolución subaguda que se desarrolla en el posparto inmediato, en alrededor de un 5%-10% de mujeres, existiendo a este respecto variaciones geográficas. Se han descrito también algunos casos aislados postaborto.
Es frecuente en mujeres que han presentado niveles elevados de anticuerpos anti-TPO en el primer trimestre de embarazo así como en aquellas mujeres con diabetes mellitus tipo 1, historia familiar de patológica tiroidea autoinmune y mas dudosamente ante la presencia previa de otra patología autoinmune (artritis reumatoide, lupus eritematoso). Existe la tendencia a recidivar de este tipo de tiroiditis en e! siguiente embarazo en un 70% de casos.
Patogenia:
El mecanismo patogénico de la tiroiditis posparto muestra las mismas peculiaridades que se analizó en la enfermedad de Hashimoto, aunque es preciso recordar que al tiempo que el embarazo se acompaña de una cierta fase de inmunosupresión con tendencia a la mejoría o quiescencia de las enfermedades autoinmunes (lupus eritematoso, esclerodermia, enfermedad de Graves), el posparto inmediato se sigue generalmente de un fenómeno de «rebote» con aparición o agravamiento de la citada patológica autoinmune’*.
Clínica:
La clínica se manifiesta por el hallazgo de un bocio pequeño, indoloro y de consistencia firme que se acompaña de títulos elevados de anticuerpos antitiroides (anti-TPO y anti-Tg). En un tercio de pacientes se observa una evolución trifásica que recuerda la referida en la tiroiditis subaguda de De Quervain, al tiempo que en los demás casos puede manifestarse aisladamente con hipotiroidismo o hipertiroidismo.
En la evolución trifásica citada existe:
una fase inicial de tirotoxicosis más o menos evidente (nerviosismo, astenia, temblor, palpitaciones, etc.) que se presenta en el postparto inmediato y dura de uno a dos meses.
es seguida por una fase de hipotiroidismo (cansancio, dolores difusos, pérdida de memoria, intolerancia al frío, etc.) que dura de dos a seis meses, para luego tener lugar una recuperación de la función tiroidea.
en un 20% de casos suele persistir el hipotiroidismo antes comentado, especialmente cuando se trata de mujeres multíparas o con historia de abortos espontáneos previos.
Desde otro punto de vista, parece haberse demostrado una cierta asociación entre tiroiditis postparto, anticuerpos antitiroides y depresión posparto.
El diagnostico diferencial con la enfermedad de Graves, que puede surgir o agravarse en el posparto, se establece por el hecho de que en esta última entidad la captación de esta aumentada y existe titulo elevado de anticuerpos estimuladores del receptor de TSH.
Laboratorio y gabinete:
Ultrasonido. Presencia de una hipoecogenicidad difusa.
Tratamiento:
El hipertiroidismo transitorio que puede surgir, se suele tratar con bloqueadores Beta.
El hipotiroidismo no precisa por lo general de terapéutica, a no ser que se acompañe de síntomas o sea prolongado. En esta circunstancia se acudirá a la administración de tiroxina que se intentara retirar a los 6 o 9 meses para comprobar si el cuadro clínico ha remitido.
En la actualidad es objeto de controversia la práctica de un despistaje habitual posparto con objeto de detectar esta entidad, mediante la determinación de TSH y/o anticuerpos antitiroides. Por otra parte, se han descrito la existencia de estudios encaminados a prevenir el desarrollo de tiroiditis posparto en sujetos con positividad de anticuerpos antitiroides en el embarazo mediante la administración de tiroxina durante la gestación o en las semanas posparto.
3. TIROIDITIS INDOLORA O SILENTE ESPORÁDICA.
Tiroiditis de evolución subaguda con anticuerpos antitiroides positivos, similar a la tiroiditis posparto en cuanto a mecanismo patogénico,
Puede presentarse a cualquier edad, siendo el pico más frecuente de aparición entre los 30 y 40 años.
Al no relacionarse con una situación definida como es el posparto, su diagnostico puede resultar a veces difícil.
Este tipo de tiroiditis tiene tendencia a la recurrencia y la actitud terapéutica a seguir debe ajustarse a una pauta parecida a la establecida en la tiroiditis posparto.
TIROIDITIS FIBROSA O TIROIDITIS DE RIEDEL
Etiología
Inflamación tiroidea de etiología desconocida, si bien para algunos autores seria una modalidad más de tiroiditis autoinmune, ya que suele acompañarse en ocasiones de una elevación de la tasa de anticuerpos antitiroides.
La tiroiditis fibrosa incide con preferencia entre los 30-60 años y es más frecuente en mujeres que en hombres.
Clínica:
Podemos encontrarnos un tiroides normal o aumentado de tamaño, de consistencia pétrea y asociado en ocasiones a manifestaciones compresivas, en relación con la antes referida infiltración fibrosa, tales como disfagia, disfonía o disnea. Existe generalmente normo función tiroidea, si bien puede presentarse a veces un cierto grado de hipotiroidismo.
La «dureza» del tiroides y las manifestaciones infiltrativas, propias de la tiroiditis de Riedel, pueden llevar a plantear el diagnostico diferencial con la presencia de un carcinoma indiferenciado de tiroides, circunstancia que puede ser resuelta con la práctica de una PAAF, si bien muchas veces resulta difícil su realización por la citada «dureza» de la glándula y entonces es precise acudir a la biopsia tiroidea a «cielo abierto».
Tratamiento:
Quirúrgicos en caso de problemas compresivos.
En fases iniciales del proceso se describen experiencias terapéuticas con glucocorticoides y tamoxifeno.
La administración de tiroxina estará indicada, como es lógico, ante situaciones de hipotiroidismo.
TIROIDITIS INDUCIDA POR FÁRMACOS.
La administración de determinados fármacos, más frecuentemente en pacientes con signos previos de autoinmunidad, actuando bien por acción directa o a través de mecanismos autoinmunes, pueden propiciar el desarrollo de procesos inflamatorios tiroideos.
Litio
En pacientes con antecedentes de autoinmunidad tiroidea la administración de litio, en el caso de su empleo en cuadros de psicosis maníaca, puede conducir a un aumento de la tasa de anticuerpos antitiroides y a propiciar el desarrollo de un cuadro de hipotiroidismo subclínico o clínico. Ocasionalmente existe la aparición de tirotoxicosis tras tratamiento prolongado con litio en posible relación con un efecto toxico directo del mismo sobre las células foliculares tiroideas o como consecuencia de la puesta en marcha de una tiroiditis silente.
Amiodarona
La amiodarona, fármaco antiarrítmico, contiene en su molécula elevada cantidad de yodo, por lo que su administración puede originar diferentes tipos de patología tiroidea.
Puede dar lugar al desarrollo de hipotiroidismo, especialmente en áreas con aporte suficiente de yodo y existencia previa de nodularidad o autoinmunidad tiroidea, como consecuencia de una inhibición en la organificación tiroidea de ioduro (fenómeno Wolff-Chaikoff).
Otra manifestación es la presencia de tirotoxicosis tipo I, que se produce como consecuencia de un aumento en la síntesis y secreción de hormonas tiroideas, en relación con el aporte excesivo de yodo. Esta alteración se presenta con más frecuencia en zonas deficitarias de yodo y ante la existencia previa de patología tiroidea (bocio nodular).
La tirotoxicosis tipo I se manifestaría a veces con elevación de la tasa de anticuerpos antitiroideos. La captación tiroidea de I131 si bien estaría disminuida, se relacionaría en último término con la disponibilidad ambiental de yodo.
Suele existir una hipervascularización tiroidea (ultrasonografía con doppler).
El desarrollo de la denominada tirotoxicosis tipo II, es condicionada por una verdadera tiroiditis destructiva que se acompaña de la consiguiente liberación de hormonas tiroideas preformadas.
En la tirotoxicosis tipo II no se presentan anticuerpos antitiroideos, la captación de I131 esta disminuida y no hay aumento de vascularización, siendo discutible según estudios actuales el hallazgo de nivele elevados de interleucina 6.
En ocasiones el diagnostico resulta aun mas difícil, pues podemos encontrar asociados en un mismo paciente los dos tipos de tirotoxicosis antes citados.
La tirotoxicosis tipo I se trata con antitiroideos a dosis elevadas (metimazol), con la adición ocasional de perclorato potásico para evitar nueva captación tiroidea de yodo.
La tirotoxicosis tipo II se obtienen resultados positives con el empleo de dosis altas de glucocorticoides o con el uso de ácido iopanoico
Interferón-alfa e interleucina 6
Tras la administración de interferón-alfa en el tratamiento de hepatitis crónica y de interleucina 6 en el tratamiento de leucosis y tumores malignos se ha podido detectar la presencia de anticuerpos antitiroides (anti-TPO), junto con la asociación ocasional de hipertiroidismo clínico o subclínico o de hipotiroidismo, como consecuencia de la inducción de una tiroiditis inflamatoria similar a una tiroiditis linfocitaria indolora.
La aparición de estas manifestaciones clínico-bioquímicas parece relacionarse con el sexo femenino, edad y existencia de antecedentes de autoinmunidad tiroidea. Aunque la función tiroidea suele normalizarse al discontinuar la terapia con citocinas, los sujetos afectos tienen un mayor riesgo para el desarrollo posterior de una nueva patología autoinmune tiroidea.
¿Qué es el cáncer?
El cáncer incluye a un grupo muy diverso de enfermedades que pueden afectar a cualquier órgano. Todos los cánceres se originan en células, las células son la unidad básica del organismo vivo. Las células forman los tejidos y estos a su vez forman los distintos órganos como el tiroides. Normalmente las células crecen y se dividen para formar nuevas células. A medida que el cuerpo las necesita, cuando las células envejecen y mueren, otras células ocupan su lugar. A veces este proceso se desordena, nuevas células aparecen cuando el cuerpo no las necesita, las células viejas no mueren cuando debieran y otras crecen desordenadamente. Todo este desorden provoca la aparición de una masa o tumor.
Los tumores pueden ser benignos o malignos (cáncer). Los tumores cancerosos son aquellos que aparte de crecer desordenadamente tienen capacidad de invadir los órganos vecinos y diseminarse a distancia a través de los vasos sanguíneos y los vasos linfáticos, apareciendo siembras (metástasis) en otros órganos. La mayoría de los tumores del tiroides (nódulos) son benignos (90%), no invaden ni se diseminan a otras partes del cuerpo y no suelen representar una amenaza para la vida del paciente. Los tumores benignos del tiroides (nódulos) raramente malignizan, los tumores son benignos o malignos de entrada.
Cáncer de tiroides
Los tumores malignos más frecuentes pueden ser de cuatro tipos. Por orden de frecuencia son: cáncer papilar, folicular, medular y anaplásico. Curiosamente también por este orden van de mejor a peor pronóstico.
- Los carcinomas papilares y foliculares, que englobamos como tumores bien diferenciados, representan el 80-90% de los cánceres de tiroides, se originan en las células foliculares, que son las que fabrican la hormona tiroidea, y captan el yodo. Son de crecimiento lento y si son diagnosticados a tiempo tienen un pronóstico excelente.
- El cáncer medular comprende el 5-10% de los cánceres de tiroides. Se origina en las células C productoras de calcitonina. Puede ser de tipo familiar por una alteración genética y a veces se asocia a otros tumores endocrinos. La determinación de calcitonina en sangre puede servir de marcador tumoral.
- El cáncer anaplásico es el mas raro y agresivo de los tumores de tiroides, fácilmente invade los tejidos vecinos y se disemina a distancia.
Cuando un tumor maligno se disemina a distancia a través de los vasos linfáticos, sanguíneos o de los nervios, se dice que metastatiza. Las metástasis más frecuentes de los tumores tiroideos son a los ganglios linfáticos, pero pueden aparecer también en otros órganos como los pulmones o huesos. Las metástasis están compuestas por el mismo tipo de células que el tumor original y se comportan como ellas. Una metástasis pulmonar de un carcinoma de tiroides no se trata como un tumor primario del pulmón.
La causa de los cánceres de tiroides no se conoce y no se contagia. Hay una serie de factores de riesgo que hacen que algunas personas tengan mayor riesgo de contraer esta enfermedad. Entre estos factores tenemos la exposición a altas dosis de radiación (radioterapia cervicofacial, Hiroshima, Chernobil etc.) La historia familiar o el sexo femenino son otros factores de riesgo.
El tratamiento del cáncer de tiroides depende del tipo y tamaño del tumor, de la edad del paciente y de si el tumor se ha diseminado. Las diferentes opciones como la cirugía, yodo radioactivo, tratamiento hormonal, radioterapia o quimioterapia o una combinación de ellas deben ser discutidas con su médico, ya sea el endocrinólogo, cirujano u oncólogo. La cirugía para la extirpación del tumor y normalmente de todo el tiroides es el tratamiento mas frecuente, en estos casos posteriormente el paciente debe seguir un tratamiento substitutivo con hormona tiroidea. En la mayoría de los tumores bien diferenciados que son los más frecuentes además se utiliza el tratamiento con yodo radioactivo que destruye solo las células tiroideas ya sean benignas o cancerosas.
La mayoría de los tumores tiroideos son de muy buen pronóstico, pero aparte de recibir el tratamiento correcto, los pacientes deben seguir controles periódicos por su especialista. Estos controles incluyen la exploración clínica, analítica o pruebas como la ecografía o gammagrafía.
Cirugía del tiroides
La cirugía del tiroides es delicada como todo tipo de cirugía, pero en este caso lo es especialmente por la situación de la glándula que se halla en el cuello rodeada de estructuras importantes como la tráquea, esófago, arterias carótidas, venas yugulares, nervios recurrentes, glándulas paratiroides etc. La ventaja es que en el cuello hay poco cúmulo de grasa, lo que facilita la identificación de todas estas estructuras. Es aconsejable que este tipo de cirugía la realicen cirujanos expertos en el tema y en CENTROs de referencia.
La cirugía tiroidea, a pesar de su complejidad, suele ser poco agresiva y muy bien tolerada por el paciente. Es poco dolorosa y permite iniciar la dieta oral y deambulación a las pocas horas de finalizada la intervención. El paciente puede hablar normalmente el mismo día de la intervención. La estancia en el CENTRO es de dos a tres días.
La tiroidectomía (extirpación de la glándula tiroides) puede ser total (de ambos lóbulos) o parcial (hemitiroidectomía, istmectomía etc.) En ocasiones deben extirparse también los ganglios linfáticos. Estas intervenciones se realizan bajo anestesia general, suelen durar de una a tres horas y después de la intervención, el paciente debe permanecer unas horas en la unidad de recuperación anestésica para que aparte de controlar sus constantes vitales como después de cualquier intervención, se controle especialmente su respiración (ventilación), pues un sangrado brusco al toser o vomitar podría comprometer la vía respiratoria. Por este motivo se deja un drenaje de la herida.
Los pacientes a los que se les extirpa toda la glándula tiroides deben recibir tratamiento substitutivo con hormona tiroidea. Este tratamiento consiste en la administración de un comprimido diario de levotiroxina. Es fácil de controlar y no debe producir ningún efecto dañino ni ningún cambio en el metabolismo del paciente, por tanto no tiene porqué aumentar de peso como consecuencia de la tiroidectomía. Este tratamiento y control lo realiza el endocrinólogo del paciente.
Las complicaciones de la cirugía tiroidea son poco frecuentes, pero como en cualquier tipo de cirugía existen y deben tomarse las medidas necesarias para tratar de evitarlas, las más frecuentes son:
- Hipoparatiroidismo. Las glándulas paratiroides son cuatro pequeñas glándulas del tamaño de una lenteja, que fabrican parathormona, una sustancia que regula el metabolismo del calcio. Durante una tiroidectomía total estas glándulas deben ser identificadas y preservadas. Se hallan adheridas a la cápsula del tiroides. Al extirparlo hay que separarlas de la cápsula, por lo que ocasionalmente quedan desvitalizadas (mala irrigación sanguínea) y por tanto funcionan mal transitoriamente. Este hipoparatiroidismo debido a la menor producción de parathormona provoca una disminución del calcio en sangre que hay que corregir. La hipocalcemia transitoria es relativamente frecuente y se corrige espontáneamente. Sólo un 1% de los pacientes tiroidectomizados presentan hipoparatiroidismo permanente.
- Otra complicación importante y también muy infrecuente (<1%) es la afonía por lesión del nervio recurrente. Los nervios recurrentes son dos nervios que inervan las cuerdas vocales y pasan justo por detrás de los lóbulos tiroideos. En toda intervención sobre el tiroides deben identificarse y preservarse. Un cáncer de tiroides al crecer e invadir puede afectar al nervio recurrente y provocar afonía.
- El sangrado postoperatorio (hemorragia) puede producirse como en cualquier herida quirúrgica. Como hemos mencionado el paciente después de la intervención es controlado en la unidad de reanimación anestésica y si se produce una hemorragia se resuelve inmediatamente sin mayores consecuencias.
- La infección de la herida es rarísima por tratarse de cirugía limpia.
- La mortalidad operatoria en la cirugía tiroidea es bajísima, de hecho es menor que en la cirugía de la apendicitis y debería ser como consecuencia de alguna enfermedad de base del paciente. En nuestra amplia experiencia con la cirugía tiroidea (más de 1.000 pacientes) tenemos una mortalidad cero.
¿Qué son las paratoroides?
Las paratiroides son cuatro pequeñas glándulas de unos 30-35 mg de peso que se encuentran adheridas a la cápsula de los cuatro polos del tiroides, su número puede variar de tres a cinco y su localización puede variar en el cuello o el tórax.
Su función es la de producir parathormona, una sustancia que se encarga de regular el metabolismo del calcio. Esta hormona aumenta la absorción intestinal de calcio y la descalcificación de los huesos. Como consecuencia aumenta en nivel de calcio en la sangre (hipercalcemia) así como la eliminación de calcio por el riñón y orina. El exceso de producción de esta hormona se denomina hiperparatiroidismo, el déficit es el hipoparatiroidismo.
¿Qué es el hiperparatiroidismo?
Es el exceso de parathormona. En un 80-90% de los casos es producido por un tumor de una de las glándulas, normalmente benigno (adenoma) y raramente maligno (carcinoma). En el resto de los casos se da como consecuencia de una hiperplasia (crecimiento) de las cuatro glándulas.
Es una enfermedad muy frecuente aunque muchas veces no se diagnostica. La hipercalcemia (aumento del nivel de calcio en sangre) es el dato que suele hacer sospechar el diagnóstico. Los signos y síntomas más frecuentes los podemos dividir en tres grupos: síndrome esquelético como consecuencia de la descalcificación de los huesos y puede incluir dolores oseos, una variedad de osteoporosis (osteitis fibrosa quística) fracturas etc.. síndrome urológico por el aumento de la eliminación de calcio por el riñón, incluye la aparición de cálculos renales, un 5-10% de los pacientes que tienen “piedras en el riñón”, padecen hiperparatiroidismo, puede producirse una nefrocalcinosis (calcificación de los riñones) y terminar en una insuficiencia renal. Elsíndrome hipercalcémico puede incluir cansancio, depresión, pérdida de peso, irritabilidad, molestias digestivas. También se puede asociar a pancreatitis aguda, úlceras gastroduodenales y a otros tumores endocrinos del tiroides, páncreas o suprarrenales.
La sintomatología depende del grado de enfermedad y puede ir desde sintomatología grave hasta la ausencia de síntomas (paciente asintomático).
El diagnóstico suele sospecharse por un análisis que muestra hipercalcemia y se confirma por la determinación analítica de un aumento del nivel de parathormona en la sangre. Existen pruebas (ecografía, gammagrafía y scanners) para visualizar el tumor (adenoma, carcinoma) o tumores (hiperplasia) responsables de esta enfermedad.
El tratamiento consiste en la extirpación quirúrgica del tumor o tumores causantes de la enfermedad. Cuando hay síntomas la necesidad de la intervención es evidente pues la progresión de la enfermedad puede tener consecuencias muy graves. Los pacientes que no tienen síntomas, si no son operados deben ser controlados estrechamente.
Antes de intervenir quirúrgicamente a un paciente con hiperparatiroidismo, suelen practicarse pruebas de localización (ecografías, gammagrafías etc.) para ver si la enfermedad afecta únicamente a una glándula, que es lo más frecuente, y saber cuál es la glándula que tiene el tumor (adenoma) para poder realizar una operación muy poco agresiva, dirigida a extirpar únicamente la pequeña glándula enferma.
El control postoperatorio inmediato es muy importante pues muchos pacientes presentan una disminución brusca del calcio en sangre debida a la disminución del estímulo de la parathormona. Los huesos se recalcifican absorbiendo el calcio de la sangre. Frecuentemente estos pacientes requieren una administración extra de calcio por vía endovenosa u oral hasta que se recalcifican los huesos y se consigue el equilibrio y normalización del nivel de calcio en sangre.
¿Qué es un quiste tirogloso?
La glándula tiroides en la fase embrionaria se forma en la base de la lengua y antes del nacimiento emigra hasta su posición normal en la base del cuello. El conducto que se forma como consecuencia de este descenso, normalmente se atrofia y desaparece. Ocasionalmente parte de este conducto persiste formándose un quiste tirogloso. Estos quistes son pues defectos congénitos que suelen aparecer en niños o jóvenes pero pueden desarrollarse también en un adulto.
Se presentan como “un bulto” de pocos centímetros de diámetro, normalmente no doloroso situado en la parte central alta del cuello por encima de la laringe (nuez de Adán). Suelen crecer lentamente aunque en ocasiones aumentan bruscamente de tamaño. Pueden infectarse y raramente malignizan.
El tratamiento, una vez confirmado el diagnóstico mediante la exploración física y exploraciones complementarias como la ecografía, es la extirpación completa del quiste. Para que no vuelva a aparecer deben extirparse también los restos del conducto tirogloso desde la base de la lengua y parte del hueso hioides (intervención de Sistrüng). Esta intervención se realiza bajo anestesia general. La recuperación es rápida y el resultado estético bueno.
¿Qué es un quiste braquial?
El quiste branquial e s también un defecto congénito aunque menos frecuente que el quiste tirogloso. Se debe a un defecto embrionario por falta de fusión del segundo y tercer arco branquial. El feto en su primera fase del desarrollo embrionario tiene branquias como los peces y anfibios.
Puede aparecer como una fístula (apertura externa o comunicación) o un quiste. Igual que el quiste tirogloso, es más frecuente en gente joven pero también puede desarrollarse en el adulto.
El quiste se localiza en la parte lateral del cuello, detrás del borde anterior del músculo esternocleidomastoideo. Estos quistes pueden infectarse. Para confirmar el diagnóstico pueden practicarse pruebas como la punción, ecografía etc.
El tratamiento es quirúrgico y consiste en la extirpación completa del mismo. La punción y vaciado del quiste sirve para el diagnóstico pero al persistir la cápsula en quiste se vuelve a llenar y las punciones repetidas facilitan la infección lo que a su vez complicaría el tratamiento quirúrgico. Es una intervención de bajo riesgo y recuperación rápida.
Nódulo Tiroideo No Palpable / Incidental. Consenso Nacional
Definición de incidentaloma tiroideo
Es un término utilizado en varios ámbitos de la endocrinología, que se refiere a nódulos no palpables que se encuentran en exámenes de cabeza y cuello, realizados por una razón que no sea específicamente una búsqueda de este problema.
Se realizan hallazgos en ecografías cervicales por varias causas, entre ellas búsqueda de patología vascular carotídea, que nos aporta un número importante de enfermos, ya que se ha hecho una técnica bastante popular; estudios de adenopatías, evaluación de un nódulo tiroideo palpable, evaluación de patología paratiroídea y en el último tiempo algo que se puede someter a discusión, el screening o tamizaje. En muchos casos, médicos no especialistas, en la evaluación de la tiroides solicitan una ecografía tiroidea basal.
Epidemiología
La incidencia de nódulos tiroideos palpables inicialmente, es de 0,1% por año en Estados Unidos y probablemente es similar en los países de Latinoamérica, lo que corresponde a una prevalencia de un 4 a 7% en la población general.
De los nódulos tiroideos descubiertos incidentalmente por ecografía, 50% no habían sido previamente consignados al examen físico, a pesar de que muchos de ellos debieron ser palpables, porque medían más de 2 cm. Muchas veces esto ocurre porque existen algunas dificultades técnicas para palpar el cuello.
Experiencias clínicas
Cuando tratamos de acotar el problema y encontrar de qué estamos hablando en términos de importancia, debemos citar uno de los primeros trabajos realizados para intentar responder esa pregunta. Se tomaron 100 voluntarios asintomáticos y se les hizo una ecografía de alta resolución (con transductor de más de 10 megahertz); 67% de estos voluntarios sanos presentaban uno o más nódulos a la ecografía y 72% de estos casos correspondieron a mujeres. Por lo tanto es un hallazgo más común en el sexo femenino.
La prevalencia de al menos un nódulo incidental en la glándula tiroides, utilizando estas ecografías de alta resolución, en diferentes series, está entre 40% y 67%, de manera que sería un problema muy prevalente.
En un trabajo del año 1955, ya se había descrito este fenómeno de nódulos pequeños en pacientes teóricamente sanos: en un estudio de autopsias, en más de 800 pacientes, se encontró que aproximadamente 50% de las tiroides tenían algún nódulo, de los cuales 35% correspondía a nódulos de más de 2 cm, pero que no habían sido descritos en el paciente vivo.
Importancia clínica
La importancia que esto tiene se relaciona con el riesgo de malignización que presentan estos nódulos. Hasta ahora no existe ningún estudio observacional y prospectivo que nos permita saber exactamente cuál es el pronóstico de los nódulos pequeños encontrados incidentalmente en una ecografía. Lo que sí existe son estudios transversales en necropsias, en que la malignidad de estos nódulos incidentales está en un rango demasiado alto para ser útil como número, porque hay series que muestran que entre un 0,4% y 12,5% de malignidad en este tipo de patología.
Si seguimos intentando acotar este riesgo de malignidad, la prevalencia de cáncer oculto en autopsias de cánceres menores a un centímetro, corresponde, en series distintas, aproximadamente a 4% de carcinomas medulares ocultos. Este antecedente se ha intentado acotar específicamente en los nódulos que hemos encontrado en las ecografías. En un trabajo clásico, en que se hicieron punciones citológicas en 109 nódulos pequeños, buscando cuál era la incidencia de malignidad, se encontró que había un 4,2% de cánceres, versus 31%, que era lo que reportaba el mismo grupo en nódulos palpables. Cabe señalar que esta es una incidencia especialmente alta; esto podría hacer pensar que la incidencia de carcinoma en nódulos palpables está sobredimensionada, lo que magnifica la diferencia con la encontrada en nódulos no palpables. En un grupo que restringió el análisis a nódulos no palpables, pero mayores de un centímetro, la prevalencia de malignidad aumentó de 4,2% a 7,2%.
En el trabajo más grande publicado, en el año 1999, se analizan 450 nódulos no palpables, de los cuales fueron operados 90. Se encontró 20 cánceres en este grupo, de los cuales 8 eran menores de un centímetro y 12 mayores o iguales a un centímetro. De estos veinte cánceres, 16 habían sido diagnosticados mediante una biopsia por punción y habían encontrado además tres punciones insuficientes y un falso negativo. Las conclusiones de este grupo fueron:
Apoyar los criterios ecográficos en la decisión de una cirugía, como elemento discriminador,
Evitar las punciones en nódulos menores de un centímetro, por la alta tasa de muestras insuficientes.
Estas conclusiones marcaron una pauta y fueron repetidas en múltiples publicaciones posteriores.
En una experiencia del grupo de la Universidad Católica se encontró 452 nódulos pequeños o de difícil palpación, de los cuales se operaron 60. En nuestra casuística, con el grupo de radiología, el porcentaje de muestras insuficientes fue 6,6%, y encontramos en este grupo un 7,7% de cáncer. Si se separa por segmentos de tamaño, entre 5 a 10 mm existe un 8,5% de cáncer, entre 10 a 15 mm un 7,4%, y en mayores de 15 mm corresponde a 8,2%, lo que en promedio es igual a lo que encontramos en nódulos palpables. Estas diferencias por tamaño no son estadísticamente significativas.
En la experiencia del equipo del Hospital San Borja-Arriarán, a pesar de ser una casuística pequeña, cuando compararon nódulos palpables versus los no palpables, de un promedio de 9 mm, las cifras fueron extraordinariamente coincidentes con el grupo de la Universidad Católica. Se encuentra una incidencia de cáncer de aproximadamente 7% entre los palpables, igual a la de los no palpables.
Criterios ecográficos
Los criterios ecográficos que pueden ser considerados sospechosos en el análisis de una imagen de un nódulo tiroideo son: la hipoecogenicidad (inespecífico), las microcalcificaciones que pueden reflejar cuerpos de Samoma, pero que han sido bastante discutidos en muchas revisiones radiológicas, los bordes irregulares del nódulo que pueden reflejar disrupciones de la cápsula del nódulo, un halo periférico grueso o irregular, la ausencia de halo (que probablemente implica la presencia de invasión vascular), la presencia de adenopatías regionales y la presencia de un alto flujo intranodular en la ecografía doppler, que también es discutible. Por lo tanto es imposible distinguir ecográficamente entre lesiones benignas y malignas, con una certeza que nos permita utilizarlo como única herramienta de discriminación.
Factores de riesgo
Los factores de riesgo no sólo dependen del nódulo, también dependen de los factores de riesgo de la persona. Entre estos, clásicos ejemplos antiguos son el déficit de yodo y la presencia de otras sustancias que pueden ser naturales como los piñones, o sustancias como el litio, pero que han sido bastante discutibles. En cambio, las radiaciones externas sí corresponden a un factor de riesgo: por ejemplo la presencia de radiación externa en la región cervical en niños es un factor de riesgo, claramente predictor de mayor incidencia de cáncer y se asociaría a la inducción de algunas formas del oncogen Reb, relacionado con el cáncer papilar de tiroides. La radiación externa es lo que importa, porque se ha visto, en varias revisiones, que los tratamientos previos con yodo131, indicados, por ejemplo, ante un hipertiroidismo, no constituyen un factor de riesgo.
Nódulo tiroideo y embarazo
Otros factores de riesgo son los nódulos tiroideos que se detectan o que aparecen durante el embarazo, porque se sabe que la HCG tiene un efecto TSH-símil, que favorece el crecimiento de los nódulos o induce la aparición de ellos. En un trabajo realizado por Fernando Munizaga, la detección y aumento del tamaño de un nódulo tiroideo preexistente durante el embarazo podría tener un mayor riesgo de cáncer. Esto, que había sido discutido y corroborado por otros grupos fue refutado por una publicación muy reciente, de agosto 2002, con un gran grupo de mujeres chinas, en que se demostró que sí existe una prevalencia mayor de nódulos tiroídeos, pero sin una aparente mayor incidencia de malignidad.
Las conclusiones de algunas revisiones grandes e importantes sugieren que los nódulos en la embarazada deben ser estudiados, pero que los cánceres tiroideos en las embarazadas tienen el mismo pronóstico, aunque se difiera la cirugía hasta el término del embarazo.
Otros factores de riesgo tiroideos son la enfermedad de Basedow-Graves y existe una evidencia que los nódulos fríos encontrados en esta enfermedad podrían tener una mayor incidencia de cáncer, lo que parece estar razonablemente probado. Pero, en nódulos pequeños, en pacientes con enfermedad de Graves, no se ha encontrado mayor prevalencia de cáncer, en nódulos menores de un centímetro, que son este grupo de 62 nódulos no palpados.
Otros factores de riesgo son las formas hereditarias de cáncer tiroideo. Si existe el antecedente de un carcinoma medular de tipo familiar o carcinomas papilares asociados a patología familiar, síndromes conocidos, pero bastante infrecuentes o una forma de presentación familiar de carcinomas papilares y foliculares, el riesgo relativo de tener un cáncer tiroideo en otro miembro de la familia aumenta ocho veces. Esto sería un factor de riesgo evidente en nódulos de cualquier tamaño.
Los nódulos únicos versus múltiples no tienen diferencias en cuanto al riesgo de malignidad.
Costos económicos
Lo siguiente es un resumen de los costos para manejar una patología de este tipo en nuestro medio. Una TSH cuesta entre 4.000 y 10.000 pesos, una ecografía tiroidea de calidad adecuada entre 15.000 y 30.000 pesos y una punción con biopsia bajo visión ecográfica, cuesta entre 50.000 y 100.000 pesos. Todo esto sin considerar gastos médicos y muchas otras cosas que suceden en paralelo.
De acuerdo a estos antecedentes nuestro grupo propuso algunas sugerencias como técnica de trabajo: no se deben realizar ecografías rutinarias en pacientes buscando patología tiroidea específicamente, por lo tanto desaconsejamos las ecografías tiroideas como screening.
Cuando se encuentra un nódulo tiroideo incidental y el paciente es derivado para su estudio, ¿cuál es el estudio mínimo tratando de optimizar el rendimiento desde el punto de vista costo/beneficio? Se recomienda realizar una medición de TSH. Es importante, porque debemos descartar un hipotiroidismo incidental. Si existe un hipotiroidismo en paralelo a este hallazgo, debe ser tratado y el paciente debe ser reevaluado con ecografía, luego de un tiempo de normalizada su función tiroidea. Se ha visto que en el periodo hipotiroideo el parénquima puede alterarse y muchas veces las imágenes desaparecen una vez normalizada la función del tiroides.
Es importante no pedir exámenes de más: no debe solicitarse anticuerpos antitiroideos porque los pacientes con tiroiditis crónica tienen la misma incidencia de cáncer tiroideo, pero tienen imágenes más sugerentes en la ecografía. No nos aportan desde el punto de vista diagnóstico, ni tampoco se deben solicitar cintigramas en los nódulos pequeños, porque los defectos pequeños no se ven en los cintigramas.
Conducta de nuestro servicio
Nuestra postura es la siguiente: los quistes simples no deben estudiarse; ante nódulos menores de 5 mm recomendamos realizar seguimiento; los nódulos de 5 a 10 mm también deben ser seguidos, pero existen pacientes con nódulos de este tamaño que deben ser estudiados: los niños, los pacientes con factores de riesgo establecidos, como radiación previa, cáncer tiroideo familiar y embarazadas, o si existe una característica ecográfica muy sospechosa, lo que puede ser sometido a discusión. Creemos que todo nódulo mayor de 10 mm debe estudiarse, con una punción y biopsia, bajo visión ecográfica. Así como la norma en los nódulos mayores de 10 mm es la punción, creemos que existe un grupo que puede sólo ser seguido, es decir, una excepción a la regla: serían los pacientes de mayor edad o con patología médica asociada en quienes la punción puede significar un riesgo, así como pacientes bajo tratamiento anticoagulante.
Los nódulos con calcificaciones gruesas no debieran ser estudiados porque esto es un signo de estabilidad y de falta de crecimiento, por lo tanto probablemente es un signo ecográfico de benignidad.
Si la biopsia es maligna o sospechosa, la conducta a seguir es quirúrgica. Si la biopsia es insuficiente, en los pacientes de alto riesgo es recomendable repetirla y en los pacientes de bajo riesgo debemos hacer seguimiento. Si la biopsia es benigna, se hace seguimiento del paciente.
Seguimiento del paciente
¿Qué haremos con el paciente que se somete a seguimiento? A un grupo lo vamos a tratar, probablemente, con levotiroxina. Se ha visto que el tratamiento con T4 puede reducir el tamaño nodular, pero sólo en un número pequeño de casos, 17% en las estadísticas más serias. La detención del crecimiento se puede lograr en un 10% adicional de pacientes. Deberían recibir tratamiento los pacientes jóvenes, tratando de disminuir la TSH sin suprimirla, intentando mantener niveles de 0,5 a 1 U/dl. Si al cabo de un año se observan efectos, debiera ser suspendido el tratamiento con levotiroxina, ya que no vale la pena continuar su uso en este grupo. No deben tratarse los pacientes de edad avanzada, las mujeres postmenopáusicas (por su riesgo de osteoporosis) y los pacientes que tengan contraindicaciones médicas, especialmente desde el punto de vista cardiovascular.
Tratados o no tratados
La sugerencia nuestra es que los pacientes de alto riesgo debieran realizarse una ecografía al cabo de seis meses, en los pacientes de bajo riesgo luego de 12 meses. Luego del primer control, el segundo control debe ser al cabo de un año y deben considerarse como cambios ecográficos significativos los cambios de volumen, los cambios de diámetro, mayores al 20%, siempre si éstos son mayores de 2 mm, porque si no, la técnica ecográfica no alcanza a discriminar. En la mayoría de la literatura se sugieren plazos iguales o superiores a 12 meses.

como hago para perder la grasa de la bgarira y la cintura ya llevo dos af1os tratando de quitarmela pero no he podido lo que me pasa esq tengo mucha ansiedad por comer me pueden ayudar
DEBES TENER EN CUENTA QUE LA BUENA ALIMENTACION, CONTROLADA, Y UN BUEN EJERCICIO HARAN LA DIFERENCIA
Cuál es el riesgo de que un nodulo en el tiroide se desarrolle en el trabajo de parto???
Es recomendable la Cesárea para este caso? , por aquello de la fuerza que se ejerce en labor de parto.
Gracias ateladas.
nO SE PRODUCE UN NODULO POR EMBARAZO, LOS NODULOS SON DE LENTO CRECIMIENTO Y NO POR ESFUEZO